大家好,欢迎来到专注于表观组学研究十余年的易基因,我们一直致力于多组学科研服务。
2025年11月10日,重庆医科大学检验医学院的唐睿博士作为第一作者,与重庆医科大学附属第二医院乳腺甲状腺外科的罗浩军教授及重庆医科大学检验医学院的柳满然教授合作,在肿瘤学领域的顶级期刊《Cancer Communications》(IF24.9/Q1)上发表了题为“未折叠蛋白应答激酶PERK通过SAM合成和H3K4me3依赖性PDGFB信号支持循环肿瘤细胞簇的存活和转移”的科研成果。该研究集中探讨了循环肿瘤细胞簇(CTC clusters)在血液环境中的存活与转移机制,揭示了CTC clusters通过激活未折叠蛋白应答(UPR)中的关键激酶PERK,参与调控蛋氨酸代谢通路(MAT2A介导的SAM合成),从而促进组蛋白修饰H3K4me3在PDGFB启动子区域的富集,最终通过PDGFB-PDGFRβ信号轴激活PI3K/AKT途径,增强CTC clusters的转移能力。这项研究首次阐明了PERK/SAM/H3K4me3/PDGFB轴在CTC clusters适应性存活中的核心作用,为针对转移前体细胞的治疗提供了新思路,并为开发新的抗肿瘤转移策略奠定了理论基础。

标题:
未折叠蛋白应答激酶PERK通过SAM合成和H3K4me3依赖性PDGFB信号支持循环肿瘤细胞簇的存活和转移
发表时间:2025年11月10日
发表期刊:Cancer Communications
影响因子:IF24.9/Q1
技术平台:代谢组学、表观组学(ChIP-seq)、转录组学(RNA-seq)等(易基因金牌技术)
客户单位:重庆医科大学
DOI: 10.1002/cac2.70072

背景:
转移是导致癌症相关死亡的主要原因,循环肿瘤细胞簇(CTC clusters)被认为是高效的远端转移前体细胞。CTC clusters在血液中的存活是肿瘤转移的关键因素。然而,CTC clusters如何应对血液环境并促进转移的具体机制尚不明确。本研究旨在探索CTC clusters在血液中适应和存活的潜在机制。
方法:
研究人员使用微流控系统从癌症患者、患者来源异种移植(PDX)、细胞系来源异种移植和同基因模型中分离CTC clusters。通过RNA测序(RNA-seq)、基因干扰和流式细胞术确定了CTC clusters适应性存活的关键分子。为了进一步探究适应性存活的潜在机制,研究团队还进行了RNA-seq、靶向代谢组学、同位素示踪实验、染色质免疫沉淀测序(ChIP-seq)和免疫荧光(IF)染色等实验,评估了存活通路抑制剂与化疗药物联用的治疗潜力。
结果:
研究发现,与单个CTC相比,CTC clusters显示出更强的存活和转移能力,并与较差的临床预后相关。未折叠蛋白反应(UPR)中的一个关键因子——蛋白激酶R样内质网激酶(PERK)在CTC clusters中被激活,维持了S-腺苷蛋氨酸(SAM)的水平,促进了它们在血液中的适应性存活。具体来说,PERK通过上调转录因子4(ATF4)来增强蛋氨酸腺苷转移酶2A(MAT2A)的表达,从而促进SAM的合成。SAM水平的增加增强了PDGFB启动子上的H3K4me3修饰,导致PDGFB分泌增加并在CTC clusters的细胞间区域累积。PDGFB作为共享的生存信号,通过血小板衍生生长因子受体β(PDGFRβ)激活磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)通路,支持CTC clusters在血液中的存活。抑制PERK和PDGFRβ显著削弱了生存信号,并抑制了CTC clusters的转移扩散。
结论:
本研究揭示了PERK/MAT2A/PDGFB轴在赋予CTC clusters血液中适应性存活能力方面的作用。针对这一生存信号通路的干预可能成为治疗转移性癌症的一个有前景的策略。
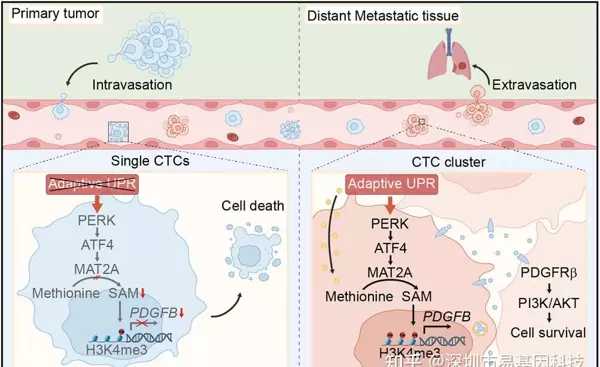
图形摘要:
UPR-PERK信号通路促进CTC clusters在血流微环境中存活的模式图。
CTC clusters通过激活适应性UPR,进一步刺激PERK-ATF4-MAT2A轴,以调节细胞内SAM的可用性。CTC clusters中SAM的积累诱导PDGFB启动子处的H3K4me3修饰,导致PDGFB表达增强。分泌的PDGFB在细胞簇的细胞间区域积累,为簇内细胞提供共同的存活信号,从而维持CTC clusters在血流中的存活。
易基因相关拓展性案例展示
- 项目文章 | ChIP-seq等揭示糖皮质激素和TET2共调控促进癌症转移的表观遗传机制
- 项目文章 | Nat Commun:中南大学曾朝阳/熊炜/龚朝建团队利用ChIP-seq等揭示头颈鳞癌免疫逃逸机制
- 项目文章 | ChIP-seq揭示H3K27me3去甲基化酶在体细胞重编程调控转录机制
- 项目文章 | CDD:ChIP+RNA-seq技术揭示NURR1在前列腺癌从基因转录到肿瘤进展中的调控机制
- 项目文章 | Hepatology/IF15.8:复旦中山医院沈英皓利用ChIP-seq及多组学解析肝癌仑伐替尼耐药机制(国人佳作)
研究方法
- 样本收集与处理:从乳腺癌、黑色素瘤、结肠癌和肺腺癌患者中收集血液样本和原发肿瘤组织,分离出CTC clusters和单个CTC,并去除白细胞和红细胞。
- 动物模型构建:利用NCG小鼠、BALB/c小鼠和C57BL/6小鼠构建患者来源异种移植(PDX)模型、细胞系来源异种移植(CDX)模型和同种异体模型,通过尾静脉注射单CTC或CTC clusters评估其转移能力。
- 分子干预和药物处理:使用CRISPR/Cas9敲除PERK、shRNA敲低MAT2A/PDGFB/ATF4,PERK抑制剂AMG44、PDGFRβ抑制剂伊马替尼、MAT2A抑制剂PF9366等联合治疗评估其对CTC clusters存活和转移的抑制效果。
- 多组学分析:
- ChIP-seq:分析H3K4me3在CTC clusters中的富集情况,结合RNA-seq数据筛选出与CTC clusters存活相关的基因。
- RNA-seq:比较PERK-KO与对照CTC clusters的转录组差异,并结合代谢组学分析揭示PERK在蛋氨酸代谢中的作用。
- 靶向代谢组学:检测SAM、SAH等蛋氨酸循环代谢物。
- 功能验证:通过流式细胞术检测凋亡(Annexin V)、细胞周期。免疫荧光/免疫组化分析pPERK、PDGFB定位。利用微流控芯片分离患者CTC,体外培养并评估药物敏感性。
结果图形
- CTC clusters是多种恶性肿瘤的高效转移前体
通过分析乳腺癌、结肠癌、黑色素瘤和肺腺癌患者血液样本,研究发现CTC clusters与患者无远处转移生存期(DMFS)缩短显著相关。在多种小鼠模型中(如PDX、CDX),CTC clusters的数量和大小在肿瘤血管中显著高于心脏血样,提示其更易被远端器官微血管捕获。体内实验显示,注射CTC clusters的小鼠比注射单CTC的小鼠更快形成肺转移灶,且存活期更短。此外,通过药物(如地高辛)解聚CTC clusters可显著降低转移负荷,证明簇状结构本身对转移效率至关重要。
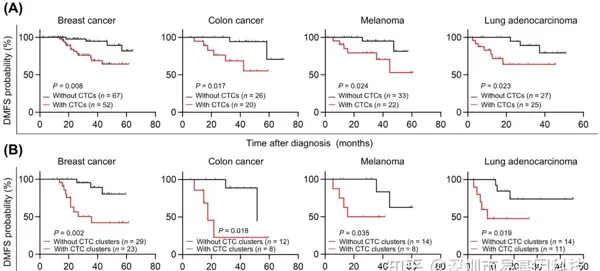
图1:CTC clusters转移能力强,预后不良。
- 适应性未折叠蛋白应答(UPR)促进CTC clusters在血液中的存活
RNA-seq分析显示,CTC clusters中相关基因显著富集,UPR通路基因(如HSPA5、XBP1)显著上调。CTC clusters表现出更强的适应性UPR反应,能够有效抵抗内质网应激(ERS)诱导的细胞死亡。在模拟血液环境的悬浮培养中,CTC clusters的内质网应激标记物(如TPE-MI)积累低于单CTC,且对ERS诱导剂衣霉素的凋亡抵抗更强。预先用UPR激活剂Azoramide处理CTC clusters可增强其肺转移能力,表明UPR激活是CTC clusters适应血液环境的关键策略。
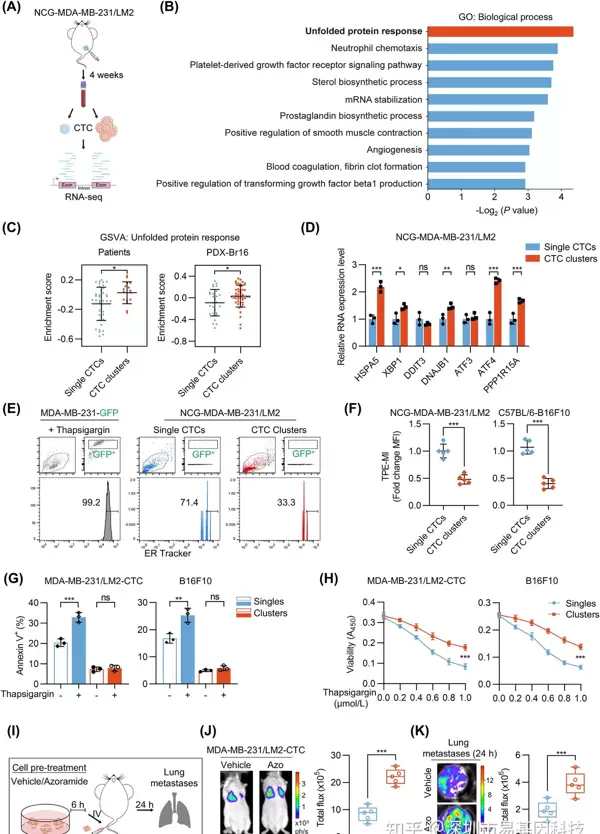
图2:CTC clusters中激活的UPR保护细胞免于死亡
- 激活的UPR-PERK信号赋予CTC clusters在血液中的存活能力
PERK在CTC clusters中的表达和磷酸化水平均高于单CTC。敲低PERK显著增加CTC clusters的凋亡率。PERK抑制剂AMG44处理使CTC clusters对衣霉素敏感,而PERK激活剂MK-28可减少凋亡。体内实验显示,PERK-KO的CTC clusters在肺转移模型中凋亡增加,证实PERK是UPR通路中维持CTC clusters存活的重要因子。

图3:PERK是促进CTC clusters存活的关键因子。
- PERK缺失抑制肿瘤转移
将PERK-KO CTC clusters注入小鼠尾静脉后,观察到肺部转移结节的数量明显减少。在原位移植PERK-KO肿瘤细胞的小鼠中,血液中的CTC clusters数量也有所下降,同时簇内的TUNEL阳性细胞数量增加。临床数据表明,PERK高表达与乳腺癌和黑色素瘤患者的不良预后有关,进一步证实了PERK在肿瘤转移中的促进作用。
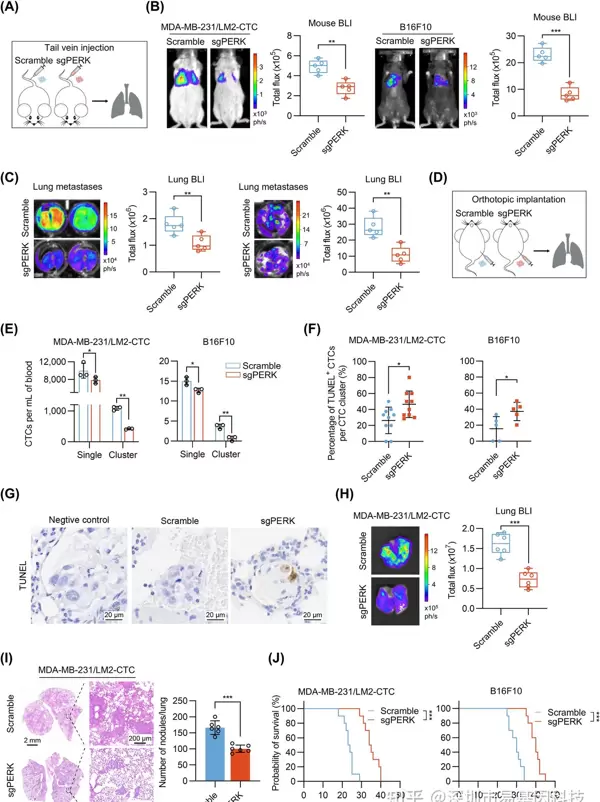
图4: PERK敲除会降低CTC clusters数量和转移能力
(5)PERK信号通过蛋氨酸代谢维持SAM的可用性
通过RNA-seq和代谢组学分析,发现PERK-KO导致蛋氨酸循环代谢物(如SAM、SAH)减少。同位素示踪实验进一步证实,PERK促进了外源性蛋氨酸向SAM的转化。具体来说,PERK通过激活下游转录因子ATF4来上调MAT2A(SAM合成的关键酶)的表达。MAT2A的敲低或蛋氨酸的剥夺均会导致SAM水平下降和细胞凋亡增加,而补充SAM则可以部分挽救这种表型。
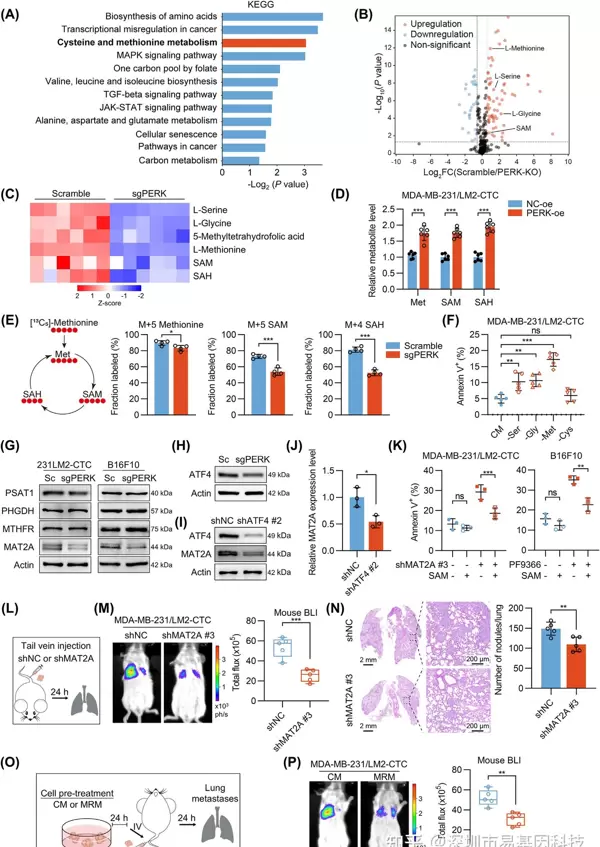
图5: PERK信号通过ATF4调控MAT2A以促进蛋氨酸代谢增强
(6)PDGFB通过SAM介导的H3K4me3甲基化修饰作为CTC clusters内的共有存活信号
结合ChIP-seq和RNA-seq的分析结果显示,SAM的积累通过H3K4me3修饰增强了PDGFB的表达。ChIP-seq分析表明,蛋氨酸限制(MRM)显著减少了PDGFB启动子区域的H3K4me3富集。补充SAM可以恢复H3K4me3水平和PDGFB的表达。进一步的机制研究表明,转录因子SP1招募组蛋白甲基转移酶SETD1A催化H3K4me3修饰,直接促进PDGFB的转录。PDGFB蛋白在CTC clusters的细胞间区域富集,通过激活PDGFRβ/PI3K/AKT通路抑制细胞凋亡,为CTC clusters提供共有的存活信号。PDGFB的敲低显著降低了CTC clusters的转移能力。
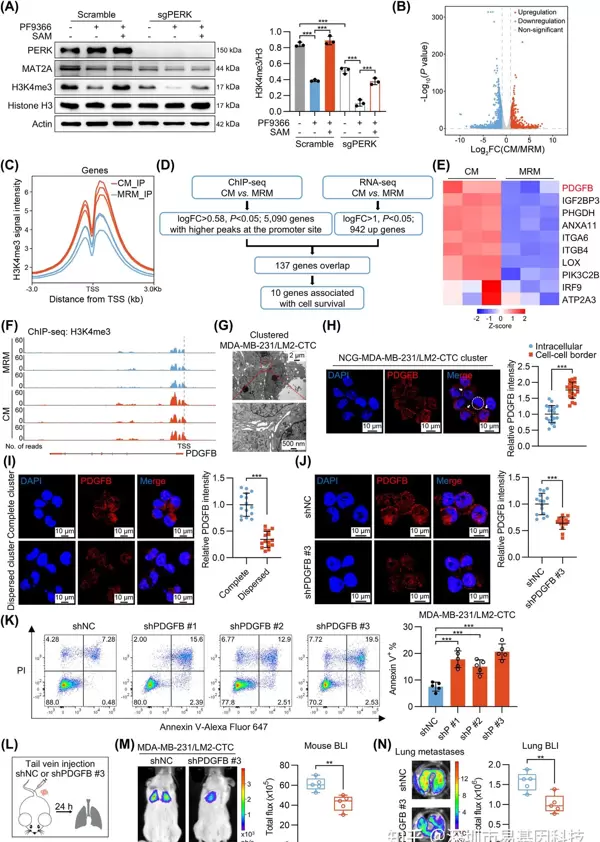
图6: 蛋氨酸代谢通过促进H3K4me3甲基化修饰,从而上调CTC clusters中PDGFB表达
- (A) Western blot分析对照组和PERK敲除的MDA-MB-231/LM2-CTC clusters在PF9366或SAM处理下的PERK、MAT2A和H3K4me3水平。
- (B) 火山图显示蛋氨酸影响的差异表达基因(n=3)。
- (C) Metaplot比较在对照培养基(CM)或蛋氨酸限制培养基(MRM)中培养的MDA-MB-231/LM2-CTC clusters的H3K4me3富集谱。图表以转录起始位点(TSS)为中心(±3.0 Kb)(n=3)。
- (D) 生物信息学分析筛选出10个与存活相关的基因作为H3K4me3下游靶点。
- (E) 热图显示在CM或MRM条件下MDA-MB-231/LM2-CTC clusters中生存相关基因的表达(n=3)。
- (F) 通过ChIP-seq展示PDGFB基因位点H3K4me3的基因组浏览器轨迹(n=3)。
- (G) MDA-MB-231/LM2-CTC clusters的透射电镜图像。
- (H-J) 免疫荧光代表性图像(左)及定量结果(右):
- (H) NCG-MDA-MB-231/LM2小鼠模型CTC clusters中PDGFB表达(n = 20);
- (I) 完整或分散的CTC clusters中PDGFB表达(n = 15);
- (J) 对照组或PDGFB敲低CTC clusters中PDGFB表达(n = 15)。
- (K) 流式细胞术代表性图像(左)及对照组(shNC)与PDGFB敲低组(shP#1/2/3)CTC clusters中AnnexinV凋亡细胞定量(右)(n=5)。
- (L) 实验设计示意图:通过尾静脉向NCG小鼠注射MDA-MB-231/LM2-CTC clusters(shNC和shPDGFB #3),24小时后通过生物发光成像评估转移负荷。
- (M-N) 尾静脉注射后24小时肺转移的生物发光图像(左)及荧光强度定量(右)(n=5)。
(7)靶向PERK/PDGFRβ作为转移性肿瘤的治疗策略
在PDX模型中,PERK抑制剂AMG44与PDGFRβ抑制剂伊马替尼联合使用,显著减少了CTC clusters的数量、原发肿瘤负荷和肺转移。患者来源的CTC体外实验进一步证实,联合用药可以协同抑制细胞活力,表明双重靶向PERK和PDGFRβ具有临床转化潜力。

图7: AMG44 和伊马替尼的联合疗法能够减少CTC clusters的数量并抑制转移
结论和启示
本研究通过整合转录组学、代谢组学和ChIP-seq技术,揭示了PERK/MAT2A/PDGFB轴在CTC clusters存活和转移中的关键作用。开发的靶向PERK和PDGFRβ的联合治疗策略为抑制肿瘤转移提供了新的思路。ChIP-seq技术在本研究中发挥了重要作用。
通过对H3K4me3修饰的分析,揭示了PDGFB作为循环肿瘤细胞簇(CTC clusters)生存信号的分子机制。未来的研究可以通过采用ChIP-seq技术,进一步探讨其他表观遗传修饰在肿瘤转移过程中的作用,为新型治疗策略的开发提供科学依据。
易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation, ChIP)是一种经典的技术,用于研究体内蛋白质与DNA的相互作用。当ChIP技术与高通量测序技术结合时,即ChIP-Seq,能够在全基因组水平上高效且精准地筛选和鉴定特定蛋白质的DNA结合位点,为后续研究提供了坚实的基础。
DNA与蛋白质的相互作用对于基因转录、染色质的空间结构及其构象至关重要。通过使用针对特定组蛋白修饰、DNA结合蛋白或转录因子的特异性抗体来富集与其结合的DNA片段,随后进行纯化、文库构建及高通量测序,研究者能够通过将所得数据与参考基因组进行精确比对,了解特定组蛋白修饰或转录因子在整个基因组上的分布情况,以及多个样本间的差异。
应用方向
- 确定不同时间和空间条件下蛋白质在基因或基因组上的定位
- 研究转录因子和辅助因子的结合作用
- 探究复制因子和DNA修复蛋白的功能
- 分析组蛋白修饰和变体组蛋白的作用
技术优势
- 广泛的物种适用性:适用于细胞、动物组织、植物组织及细菌等多种生物材料
- 低起始量要求:仅需5ng以上的免疫沉淀DNA即可进行测序分析
- 灵活的实验设计:可根据项目需求选择不同的组蛋白修饰特异性抗体

参考文献
Tang R, Sun Y, Deng A, et al. Unfolded protein response kinase PERK supports survival and metastasis of circulating tumor cell clusters via SAM synthesis and H3K4me3-dependent PDGFB signaling. Cancer Commun (Lond). 2025 Nov 10. doi: 10.1002/cac2.70072.
相关阅读
- Exp Mol Med|BS+ChIP-seq揭示DNA甲基化调控非编码RNA(VIM-AS1)抑制肿瘤侵袭性的机制
- WGBS+ChIP-seq等表观组分析揭示FOXM1 在抗肿瘤免疫应答中的关键调控作用
- ChIP-seq等揭示FoxO1通过增加SMC4转录和METTL14介导的m6A修饰促进卵巢癌发展的机制 | 肿瘤研究
- ChIP-seq等实验揭示CHD6在前列腺癌中转录激活的关键功能 | 肿瘤耐药研究
- 项目文章|CDD:ChIP+RNA-seq技术揭示NURR1在前列腺癌从基因转录到肿瘤进展中的调控机制
- 项目文章:郑州大学第一附属医院孙同文教授团队利用表观多组学揭示二甲双胍通过DNA甲基化和羟甲基化双向调控减轻肝损伤的保护机制
- 项目文章|Cel Rep:山东省肿瘤医院陈大卫/于金明揭示肠-肺轴介导的m6A修饰调控肿瘤抑制与免疫调节的新机制
- 项目文章|EP/7.3:浙江大学王玮课题组DNA(羟)甲基化+转录组分析揭示新型污染物诱导的表观遗传变化与癌症发生的相关性
- 项目文章|Hepatology/IF15.8:复旦中山医院沈英皓利用ChIP-seq及多组学解析肝癌仑伐替尼耐药机制(国人佳作)
- DNA-蛋白互作研究金标准 易基因ChIP-seq高分项目文章赏析




 雷达卡
雷达卡




 京公网安备 11010802022788号
京公网安备 11010802022788号







