在生物学领域,基因突变始终是研究的核心议题之一。它不仅是遗传多样性的重要来源,更是影响生物体表型特征与环境适应能力的关键分子机制。随着高通量测序技术和生物信息学分析手段的不断进步,科研人员能够通过对比不同表型个体之间的基因组差异,精准识别出与特定性状相关的关键基因。
此前,在题为“天壤之别,竟然只来自一个碱基的作用!”的文章中,已对外显子、内含子、启动子及UTR等基因区域的单碱基变异进行了初步介绍。而在与多位研究人员交流过程中发现,许多课题关注于基因不同功能区的变异影响。那么,如何系统开展此类研究?本文将围绕编码基因的主要区域——外显子、内含子、启动子和UTR,梳理相应的研究策略与技术路径。
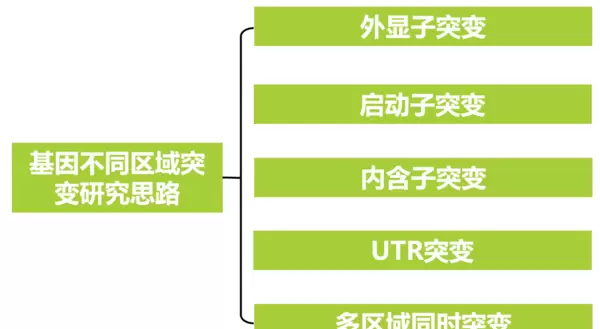
外显子区域的突变分析
在真核生物中,基因转录后经历剪接过程,去除内含子并将外显子连接形成完整的编码序列(CDS),进而翻译成蛋白质。由于外显子直接决定氨基酸序列,因此其突变往往直接影响蛋白结构与功能。
针对外显子突变的研究可从多个维度展开:包括预测或验证蛋白质结构的变化、亚细胞定位的改变、表达水平的差异以及组织特异性表达模式的变动。若涉及转基因材料,还可结合植株的表型变化进行综合分析。当目标蛋白参与分子互作时,需进一步评估突变是否干扰了其相互作用能力;若该基因为转录因子,则应考察其对下游靶基因调控活性的可能变化。
案例一:BnaC01.CCT8 外显子突变影响油菜角果与种子性状
2025年6月,中国农业科学院油料作物研究所顿小玲团队在《Plant Biotechnology Journal》发表研究,揭示了一个关键基因在油菜产量性状中的作用机制。研究团队利用乙基甲磺酸(EMS)诱变获得一个角果长度(SL)和种子重量(SW)均显著降低的突变体(ssl)。通过图位克隆、混池测序及SNP标记分析,锁定了一个约170kb的候选区间。
基于D11野生型与ssl突变体的全基因组重测序数据,研究人员发现基因 BnaC01G0509300ZS(命名为 BnaC01.CCT8)第12个外显子在57361321位点发生C→T的单碱基替换,导致其编码蛋白TCP1 theta/chap CCT theta结构域内的丙氨酸被缬氨酸取代(A507V)(见图1a-c)。结合已有文献支持,作者推测这一错义突变可能是造成表型变化的关键因素。
亚细胞定位结果显示,野生型BnaC01.CCT8与突变型BnaC01.CCT8A507V均定位于细胞核与细胞质中(图1d)。功能回补实验表明:在拟南芥atcct8-2突变背景下,过表达野生型BnaC01.CCT8可恢复茎长和种子宽度,而突变型则无此效应;在Col-0野生型中,BnaC01.CCT8-OE植株表现出更长的角果和更大的种子,但携带A507V突变的过表达株系未见明显差异。
为进一步探究作用机制,作者采用Pull-down、Split-LUC和BiFC三种方法检测BnaC01.CCT8与生长素响应因子BnaA09.ARF18之间的互作关系。结果一致显示:野生型BnaC01.CCT8能与BnaA09.ARF18结合,而A507V突变体丧失了这种相互作用能力(图2)。综上所述,A507位点的氨基酸替换严重影响了蛋白功能,最终导致产量相关性状下降。
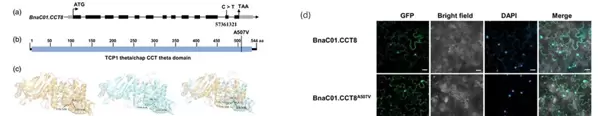
图1 BnaC01.CCT8的变异、亚细胞定位及表型分析(Qu et al., 2025)。(a)基因结构示意图,黑色条表示外显子,线条为内含子,灰色部分为非翻译区,箭头指示第12外显子中C>T的SNP位点;(b)蛋白质结构模型,蓝色区域代表保守的TCP1 theta/chap CCT theta结构域,A507V替换位置以红框标出;(c)BnaC01.CCT8及其突变体的三维结构预测对比;(d)烟草瞬时表达系统中GFP融合蛋白的亚细胞定位,DAPI染色用于标记细胞核。
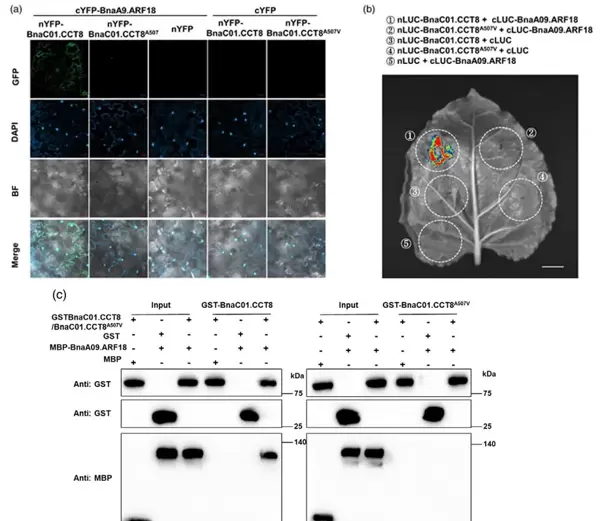
图2 BnaC01.CCT8与BnaA09.ARF18的相互作用验证(Qu et al., 2025)。(a)BiFC实验结果,显示荧光信号表明两者存在互作;(b)Split-LUC双分子萤光素酶互补试验;(c)Pull-down体外结合实验结果。
案例二:多区域变异联合解析植物生理调控网络
2025年10月,华中农业大学宋波涛课题组联合华南农业大学陈琳课题组在《Plant Physiology》发表研究成果,系统探讨了基因调控区与编码区变异对植物发育的影响。该研究不仅聚焦外显子突变,还深入分析了启动子、UTR及内含子区域的功能性变异,展示了多层次变异共同塑造复杂表型的分子基础。
通过对多个自然变异群体的整合分析,研究团队识别出若干影响激素信号通路的关键顺式调控元件变异,并结合CRISPR编辑技术验证了这些非编码区突变对基因表达丰度和时空模式的调控作用。同时,他们也发现了某些外显子突变虽不引起明显结构破坏,但通过影响剪接效率间接改变了蛋白异构体比例,从而调控生理过程。
这类综合性研究提示我们,在解析基因功能时,不应局限于外显子区域,而应全面考虑整个基因座中各类变异的潜在贡献,尤其是那些位于调控区域的沉默变异或非编码突变。
其他基因区域的研究思路概览
- 启动子区域:关注转录起始位点上游的顺式作用元件变异,可能影响转录因子结合能力,进而改变基因表达水平。可通过双荧光素酶报告系统、EMSA、ChIP等实验验证。
- UTR区域:5' UTR变异可能影响翻译起始效率,3' UTR变异则常涉及miRNA结合位点或mRNA稳定性调控,可用荧光报告载体结合定点突变进行功能测试。
- 内含子区域:尽管不直接编码氨基酸,但内含子中的剪接受体/供体位点或调控序列变异可能导致异常剪接事件,如外显子跳跃、内含子滞留等,可通过RT-PCR或全长转录本测序加以鉴定。
总之,基因不同区域的变异均可对生物功能产生深远影响。借助现代分子生物学工具与多组学整合策略,研究人员可以更加精细地解析突变背后的生物学意义,推动从“关联”到“因果”的研究跨越。
2024年6月,山东农业大学陈雪森课题组在《Advanced Science》杂志发表了一篇题为“A Functional InDel in the WRKY10 Promoter Controls the Degree of Flesh Red Pigmentation in Apple”的研究论文。该研究通过比较红肉与非红肉苹果的基因组结构变异,发现红肉苹果中WRKY10基因的启动子区域存在一段163bp的缺失序列,被命名为R-InD。
为了验证这一缺失对基因表达的影响,研究人员构建了多种启动子驱动的MdWRKY10-GFP融合表达载体,包括含有R-InD(R-InD::MdWRKY10)、不含R-InD(Def::MdWRKY10)、三倍重复R-InD(3×R-InD::MdWRKY10)以及CaMV 35S启动子驱动(35S::MdWRKY10)的类型,并将其瞬时转化至苹果愈伤组织和果实中。随后通过Western blot检测蛋白表达水平、观察转基因愈伤组织表型、测定花青素含量以及进行GUS染色实验,系统评估了不同启动子构型的转录活性。
结果表明,R-InD的存在显著增强了MdWRKY10的转录激活能力,进而促进花青素积累,导致果肉呈现红色性状(图4)。这说明启动子区域的关键顺式作用元件变异可直接影响基因表达模式及植物表型特征。
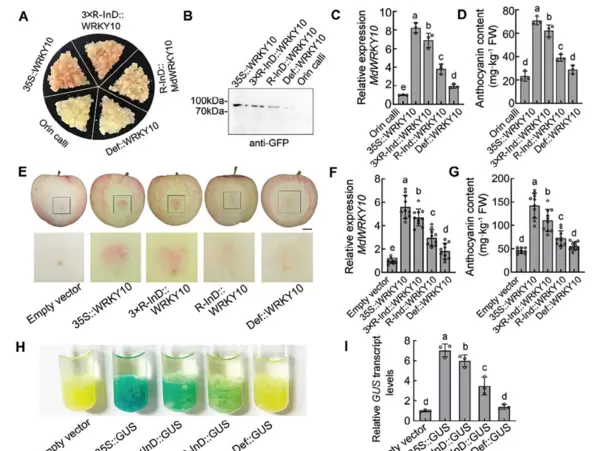
图4 R-InD序列对MdWRKY10启动子转录激活的功能分析(Wang et al., 2024)。(A)野生型“Orin”愈伤组织与转基因愈伤组织的表型对比;(B)使用GFP抗体进行Western blot检测,确认转基因产物的存在;(C)不同处理下MdWRKY10的转录水平变化;(D)相应愈伤组织中的花青素含量差异;(E)瞬时转化后苹果果肉的视觉表型;(F)瞬时转化苹果果实中MdWRKY10的表达情况。
启动子是位于基因转录起始位点上游的一段非编码DNA序列,作为RNA聚合酶和多种转录因子结合的核心区域,在调控基因时空特异性表达方面发挥关键作用。其内部顺式作用元件的种类与数量差异,是造成基因表达差异的重要原因之一。
针对启动子突变的研究,通常可采用双荧光素酶报告系统、GUS染色以及RT-qPCR等方法,比较突变前后启动子的活性及其驱动的转录水平变化。此外,还可设计启动子互换的过表达载体并进行遗传转化,进一步观察植株在表型和生理指标上的响应。若突变位点靠近重要的顺式元件,也可深入探究其是否影响上游转录因子的结合能力。对于基因编辑效率较高的物种,还可利用CRISPR/Cas9等技术对启动子区域进行定点编辑,创制稳定的突变体材料,从而更直接地验证调控机制。
另一项发表于《Nature》子刊的研究论文题为“Natural allelic variation in the CBF2 transcription factor is a pivotal factor controlling cold resistance in potato”,作者收集了来自52个不同马铃薯品种的CBF2同源基因,并进行了系统发育分析。结合已知耐寒性状的品种信息,研究初步揭示CBF2基因中“A”位点的自然变异与其抗寒能力高度相关。
具体而言,携带丝氨酸-脯氨酸(Ser-Pro)序列的第四类变异(Type 4)与高耐寒性显著关联;而第二、三类变异(Type 2/3),即该位点缺失或被亮氨酸(Leu)取代的情况,则与低温敏感性有关(图1)。基于此,研究人员选取了来源于抗寒野生种Solanum commersonii的ScCBF2(属于Type 4)和栽培种Solanum tuberosum的StCBF2(属于Type 2)进行功能验证。
与前述研究类似,本研究同样分析了蛋白结构差异、过表达植株的表型以及转录组测序数据中的差异表达模式。但由于CBF2为转录因子,因此研究重点聚焦在其下游靶基因的调控机制上。通过EMSA实验、Dual-LUC报告系统以及蛋白-DNA分子对接模拟,证实了ScCBF2、StCBF2及其功能缺失(ScCBF2m)与功能获得(StCBF2m)突变体对同一靶基因启动子具有不同的结合亲和力和调控能力。
进一步研究表明,A位点的自然变异会引起CBF2蛋白结构改变,从而影响其对GolS3启动子的转录激活效率。这种差异最终导致过表达ScCBF2的植株中棉子糖含量显著上升,而StCBF2过表达植株中棉子糖水平无明显变化,进而造成两者在耐寒性上的显著差异。
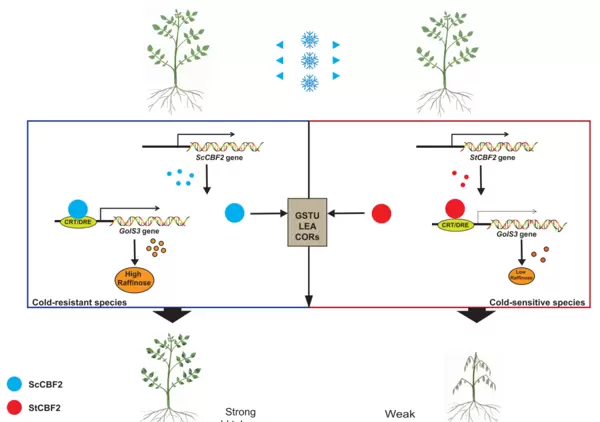
图3 ScCBF2和StCBF2在冷胁迫响应中的作用模型(Chen et al., 2025)。蓝色斑点代表ScCBF2蛋白,红色斑点表示StCBF2蛋白,后者在A位点缺少特定氨基酸残基。深黄色与浅黄色斑点分别对应ScGolS3和StGolS3蛋白。橙色椭圆象征棉子糖,其大小反映棉子糖的相对含量。实线表示已被证实的分子相互作用关系。
2025年3月,安徽农业大学夏恩华课题组在The Plant Journal上发表了一篇题为“Natural variation in promoters of F3'5'H and ANS correlates with catechins diversification in Thea species of genus Camellia”的研究论文。该研究通过代谢组学与转录组学手段分析了多种茶树品种中儿茶素的积累情况及差异表达基因。结果发现,相较于栽培型茶树,四球茶树(C. tetracocca)中EGCG(表没食子儿茶素没食子酸酯)的含量显著偏低,且类黄酮3,5-羟化酶(F3'5'H)的表达水平与茶属植物中EGCG的积累呈高度正相关。
为进一步探究其分子机制,研究人员分别克隆了舒茶早(栽培茶树)和四球茶树中F3'5'H基因的编码区及其启动子区域序列。比对结果显示,两者的编码区高度保守,但在四球茶树的启动子区域存在一个14bp的缺失片段(见图5a)。随后,作者通过实验设计对这一缺失进行了功能验证:将舒茶早F3'5'H启动子中的14bp片段删除,并将该片段回补至四球茶树的启动子中,再结合GUS染色、Y1H、Dual-LUC以及EMSA等多种实验方法进行分析。
实验结果表明,四球茶树启动子中缺失的14bp序列破坏了转录因子CsMYB1对其的结合能力,从而削弱了对F3'5'H基因的转录激活作用,最终导致EGCG合成减少(图5b-f)。这说明启动子区的自然变异是影响茶树次生代谢物多样性的重要因素之一。
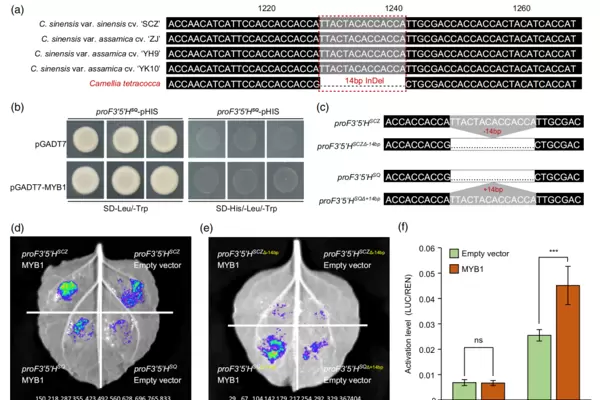
图5 四球茶树(C. tetracocca)启动子中14bp缺失的功能验证(Zhang et al., 2025)。(a)野生近缘种与栽培品种间F3'5'H启动子序列比对;(b)Y1H实验证明CsMYB1无法有效结合四球茶树(SQ)的F3'5'H启动子;(c)舒茶早与四球茶树启动子重构示意图;(d)Dual-LUC显示CsMYB1对四球茶树启动子的激活能力弱于舒茶早;(e)14bp序列的存在与否显著影响CsMYB1对F3'5'H的调控活性;(f)对应于e图的荧光值定量结果。
内含子突变的影响
尽管内含子在成熟mRNA加工过程中会被剪切掉,不直接参与蛋白质编码,但近年来的研究揭示其在基因调控中具有多重功能。例如,某些内含子可作为顺式调控元件的载体,影响启动子活性、mRNA剪接效率、核输出过程以及翻译调控;同时,部分内含子还能产生非编码RNA(ncRNA),参与基因表达的精细调节。此外,内含子还可能通过介导选择性剪接,使单个基因生成多个转录本,增加蛋白产物的多样性。
针对这类调控机制,通常可通过全转录组测序结合RT-qPCR技术来鉴定可变剪接事件,并利用报告基因系统评估特定内含子对转录活性的影响。
2023年11月,中国农业大学韩振海课题组联合吴婷课题组在Nature Communications发表题为“Pan-genome analysis of 13 Malus accessions reveals structural and sequence variations associated with fruit traits”的研究。该团队通过对13个苹果材料进行泛基因组分析,并结合结构变异的全基因组关联分析(SV-GWAS),筛选出与果皮着色相关的结构变异位点——激酶基因MdMMK2(GS07G0097300)。
研究人员对24个不同果皮颜色表型的苹果品种进行了等位基因分型,发现所有果皮无色品种均在其MdMMK2基因第四内含子中携带一段209bp的插入序列(属于LTR/Gypsy型转座元件)(图6a、e)。为了检测该内含子是否具有转录活性,从苹果果皮cDNA中扩增了该区域,结果证实无论在有色还是无色品种中,第四内含子均可被转录(图6f),提示其可能以非编码RNA形式发挥调控作用。
为验证此假设,研究者构建了包含或缺失LTR/Gypsy插入的两种表达载体(分别为MMK2-In4+和MMK2-In4),并在烟草叶片中进行荧光素酶互补成像实验。结果显示,含有该插入序列的内含子显著抑制了MdMMK2的转录水平(图6g-j),表明该结构变异通过干扰基因表达影响花青素合成途径,进而导致果皮着色缺陷。
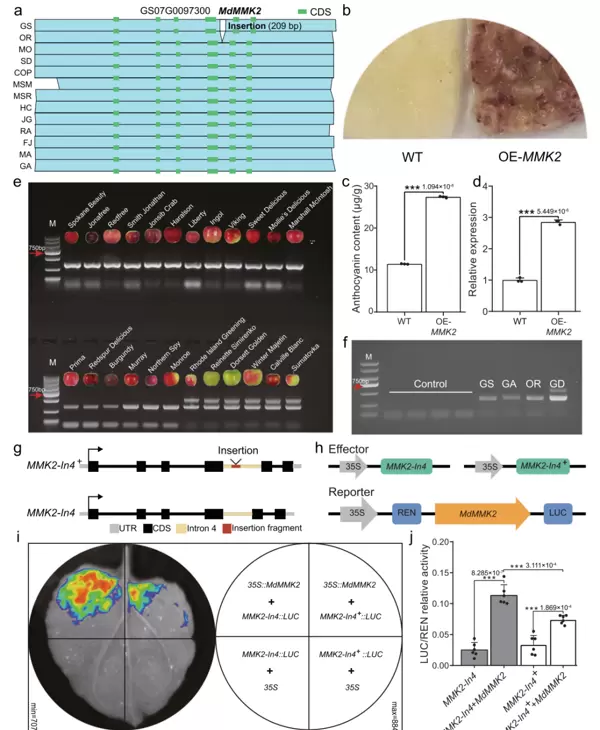
图6 MdMKK2第四内含子中LTR/Gypsy TE插入对转录的抑制作用(Wang et al., 2023)。(a)该插入事件在有色与无色苹果品种中的分布模式示意图;(b)过表达MdMMK2对苹果愈伤组织的影响;(c)转基因愈伤组织中花青素含量测定;(d)RT-qPCR检测愈伤组织中MdMMK2的相对表达量;(e)24个苹果品种中MdMMK2基因型鉴定结果;(f)从苹果果皮cDNA中扩增得到的第四内含子表达证据。
UTR突变及其在基因表达调控中的作用
UTR(非翻译区)是mRNA分子中位于编码序列两端的区域,分为5' UTR和3' UTR,虽不参与蛋白质的直接编码,但富含多种调控元件。这些元件可影响转录、剪接、mRNA稳定性以及翻译效率等多个层面的基因表达过程。因此,对UTR区域的突变研究具有重要意义。
为探究UTR突变的功能影响,可通过RT-qPCR检测其对转录水平及mRNA稳定性的改变;利用双荧光素酶报告系统、融合蛋白表达或Ribo-seq等技术比较突变前后翻译效率的变化。若突变位点位于miRNA结合区域,则还需评估其与miRNA结合能力的差异。此外,也可通过分析携带突变的转基因植株表型变化来验证功能效应。
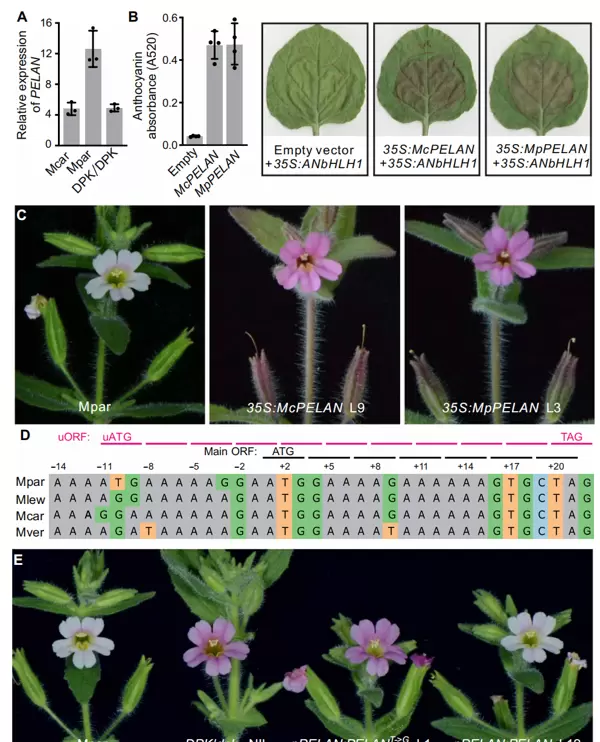
2022年9月,康涅狄格大学袁耀武课题组在《Science Advances》发表题为“Lost in translation: Molecular basis of reduced flower coloration in a self-pollinated monkeyflower (Mimulus) species”的研究论文。该研究通过构建猴面花近等基因系(NILs),并结合全基因组测序,定位到一个与花瓣颜色相关的337kb区域,其中包含一个关键的R2R3-MYB类转录因子——PETAL LOBE ANTHOCYANIN(PELAN)。
尽管未进行精细定位,研究人员仍从多个角度验证了可能的影响机制:检测不同品种中PELAN的转录水平、比对氨基酸序列差异,并在烟草中异源表达差异序列以观察花青素积累情况,同时对浅色猴面花进行稳定转化实验。结果表明,无论是基因表达量还是蛋白序列变异,均无法解释花瓣颜色深浅的差异(图7A-C)。
鉴于5'和3' UTR在翻译调控中的重要作用,作者进一步比较了四个物种间的UTR序列,发现MpPELAN基因上游存在一个单核苷酸突变(G→T),该突变产生了一个新的上游起始密码子(uATG),导致移码并可能干扰正常翻译过程(图7D)。在M. parishii中过表达包含该突变上游序列的MpPELAN未能恢复深粉红色表型;而将T回变为G后,花瓣颜色则显著加深(图7E)。
为进一步验证这一机制,研究者构建了四种不同的YFP-HA报告载体:
- (1)含有野生型MpPELAN等位基因完整移码uORF的载体(35S:uATG_OUT_ATG_YFP-HA);
- (2)将上述uATG突变为AGG的版本(35S:AGG_OUT_ATG_YFP-HA);
- (3)将uATG与主ATG置于同一阅读框内,中间插入30bp间隔序列(35S:uATG_IN_ATG_YFP-HA);
- (4)在(3)基础上将uATG突变为AGG(35S:AGG_IN_ATG_YFP-HA)。
瞬时转化烟草叶片后,采用激光共聚焦显微镜和Western blot分别检测YFP荧光信号及HA蛋白表达水平。结果显示,当存在功能性uATG时,目标蛋白的翻译受到明显抑制(图8)。这表明,MpPELAN基因上的G→T突变所产生的uATG能够有效抑制蛋白质的翻译过程。
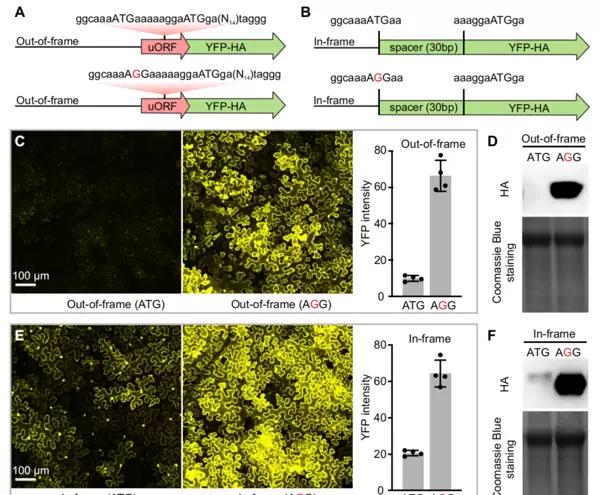
图7 PELAN的5' UTR中单个核苷酸替换是M. parishii与M. cardinalis花瓣颜色差异的根本原因(Liang et al., 2022)。(A)开花前1天采集花瓣裂片,进行qRT-PCR分析PELAN转录本相对表达量;(B)在烟草叶片中瞬时表达MpPELAN与McPELAN后的花青素积累情况;(C)在M. parishii中稳定过表达两种等位基因的表型对比;(D)序列比对显示所有物种保守的主ATG起始密码子,以及M. parishii特有的由G→T突变产生的uATG,uORF的11个密码子(含终止密码子)以洋红色标出;(E)将突变型MpPELAN等位基因中的uATG回复为AGG可恢复花青素积累,而野生型则无此效果。
第四内含子的转录状态分析
为鉴定MdMMK2基因第四内含子的转录活性,使用未经逆转录处理的RNA作为模板进行标准PCR扩增,作为阴性对照。未出现扩增条带说明样本中无基因组DNA残留。最后四泳道以苹果皮cDNA为模板进行扩增,用于验证转录事件的存在。
(g)展示了MdMMK2基因第四内含子插入(MMK2-In4+)与未插入(MMK2-In4)形式的结构示意图;(h)示意了用于实验的效应载体(表达MMK2-In4或MMK2-In4+)与包含MdMMK2的报告载体的组合设计;(i)通过荧光素酶互补成像实验验证MMK2是否具备转录激活能力;(j)对不同共浸润组合下的LUC/REN比值进行定量分析,评估其转录活性差异。
2025年7月,中国农业科学院杨学勇课题组、黄三文课题组联合英国约翰英纳斯中心丁一倞课题组在《Cell》杂志发表题为“Recessive epistasis of a synonymous mutation confers cucumber domestication through epitranscriptomic regulation”的研究论文。该研究揭示了黄瓜果实长度由两个紧密连锁的数量性状位点(QTL)FL1.1和FL1.2共同调控。当FL1.2为栽培型等位基因时,无论FL1.1的基因型如何,果实均表现为长形。
通过图位克隆与基因组测序分析,研究人员发现FL1.2位点包含一个编码乙烯合成限速酶的基因ACS2。在野生型黄瓜(C. sativus var. hardwickii PI183967,果实短圆)与栽培型黄瓜(C. sativus cv. Xintaimici,果实细长)之间,ACS2基因存在三个外显子上的同义突变、两个内含子突变以及5' UTR区域的一个3碱基Indel变异。进一步利用全长转录组测序、RNA-seq及RT-qPCR技术检测发现,这些变异并未影响RNA剪接或选择性表达水平。然而,免疫印迹结果显示,在FL1.1WFL1.2W基因型植株中,ACS2蛋白表达量显著高于FL1.1WFL1.2C植株(见图9A、B),由此推测功能差异可能源于翻译效率的变化,并初步排除了内含子突变的影响。
为进一步验证,作者采用Dual-LUC双荧光素酶系统对不同变异区域进行翻译活性分析。结果表明,携带ACS2W完整CDS序列的构建体其FLuc/RLuc活性明显升高;特别是包含第三个同义SNP(C1287)的构建体表现出更高的报告基因活性,而含有ACS2W 5' UTR的构建体则未显示任何显著效应。该结果提示,位于外显子第1287位点的C>T同义突变可能是影响ACS2蛋白翻译效率的关键因素(见图9C、D)。
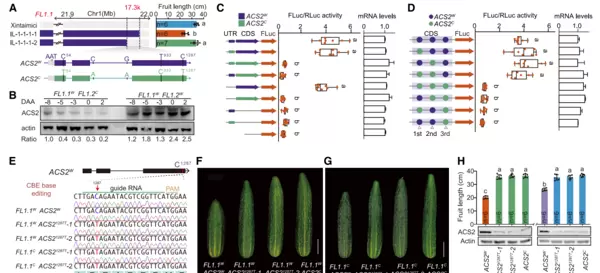
为了在体内验证这一结论,研究团队使用CBE单碱基编辑技术,将包含2kb自身启动子及ACS2全长CDS(仅在1287位点存在C或T变异)的两种构建体分别导入FL1.1WFL1.2C和FL1.1CFL1.2C背景的植株中。实验结果显示,从C到T的碱基转换显著降低了ACS2蛋白的积累水平,并促进果实伸长(见图9E–H),从而证实了双荧光素酶报告实验的推论。
本研究首次从遗传角度证明,同义突变可通过调控m6A修饰及mRNA二级结构来影响作物驯化过程中的关键农艺性状,打破了“同义突变通常不影响蛋白质功能”的传统认知。此外,该工作也展示了在面对多区域同时发生变异的情况下,如何通过精细的功能验证逐步锁定真正起作用的突变位点——即结合表型、表达分析、报告基因实验与基因编辑手段进行系统解析。
图9 ACS2基因中的同义突变影响其功能(Xin et al., 2025)。(A)FL1.2精细定位区间包含ACS2基因。上图:代表性重组体的基因型与对应果实长度,灰色和紫色分别代表新泰密刺(Xintaimici)与哈氏(hardwickii)的基因型片段;下图:ACS2W与ACS2C的基因结构及其变异示意图,方框代表外显子,线条为内含子,灰色矩形表示UTR区域;(B)免疫印迹分析显示早期果实发育阶段ACS2蛋白水平变化;(C)利用双荧光素酶报告系统对ACS2的5' UTR或CDS变异进行功能鉴定。左图展示所有5' UTR与CDS变异组合的构建体设计,中图左侧为各构建体的FLuc/RLuc活性值,右图为相应构建体中ACS2 mRNA的相对表达水平;(D)针对三个同义SNP的不同组合进行功能测试。左图显示不同SNP组合的构建体,三个点代表三个同义突变位点,中图左侧为FLuc/RLuc活性,右图为mRNA表达水平;(E)ACS21287C经碱基编辑后获得T1287的转化结果;(F、G)C1287→T突变植株的果实表型表现;(H)对应植株的果实长度测量与ACS2蛋白水平定量分析。
Wang T, Duan S, Xu C, et al. Pan-genome analysis of 13 Malus accessions reveals structural and sequence variations associated with fruit traits. Nature Communications, 2023, 14(1): 7377.
Zhang Y, Pan H, Wu Q, et al. Natural variation in promoters of F3′5′H and ANS correlates with catechins diversification in Thea species of genus Camellia. The Plant Journal, 2025, 121(6): e70108.
Chen Y, Chu Y, Wang J, et al. Natural allelic variation in the CBF2 transcription factor is a pivotal factor controlling cold resistance in potato. Plant Physiology, 2025, 199(2): kiaf428.
Qu Z, Tian Z, Wei L, et al. A chaperonin BnaC01.CCT8 contributes to silique length and seed weight by affecting auxin and jasmonic acid signalling in Brassica napus. Plant Biotechnology Journal, 2025, 23(9): 3934–3948.

Wang N, Liu W, Mei Z, et al. A functional InDel in the WRKY10 promoter controls the degree of flesh red pigmentation in apple. Advanced Science, 2024, 11(30): 2400998.
Liang M, Foster C E, Yuan Y W. Lost in translation: molecular basis of reduced flower coloration in a self-pollinated monkeyflower (Mimulus) species. Science Advances, 2022, 8(37): eabo1113.
Xin T, Zhang Z, Zhang Y, et al. Recessive epistasis of a synonymous mutation confers cucumber domestication through epitranscriptomic regulation. Cell, 2025.




 雷达卡
雷达卡




 京公网安备 11010802022788号
京公网安备 11010802022788号







