Erastin(AbMole,M2679)是一种具有细胞渗透性的喹唑啉酮类化合物,广泛应用于铁死亡研究领域。其主要通过抑制SLC7A11功能,干扰谷胱甘肽合成通路,从而有效诱导细胞发生铁死亡,在细胞生物学和肿瘤研究中受到广泛关注。
AbMole致力于为全球科研机构提供高品质的生物活性试剂,涵盖抑制剂、天然产物、细胞因子、人源单抗、荧光染料、多肽、靶点蛋白、化合物库及抗生素等产品,已被大量高水平文献与专利引用,广泛应用于基础研究与药物开发。
一、作用机制解析
1. 抑制System Xc?介导的铁死亡通路
Erastin(AbMole,M2679)最初在高通量筛选中被鉴定为一种可选择性杀伤携带RAS突变肿瘤细胞的化合物。值得注意的是,该化合物引发的细胞死亡不能被经典凋亡抑制剂所阻断,表现出与传统凋亡明显不同的特征,这一发现推动了新型程序性细胞死亡形式——铁死亡的研究进程[1]。铁死亡的核心特征是细胞内活性氧(ROS)水平升高以及脂质过氧化物的累积。
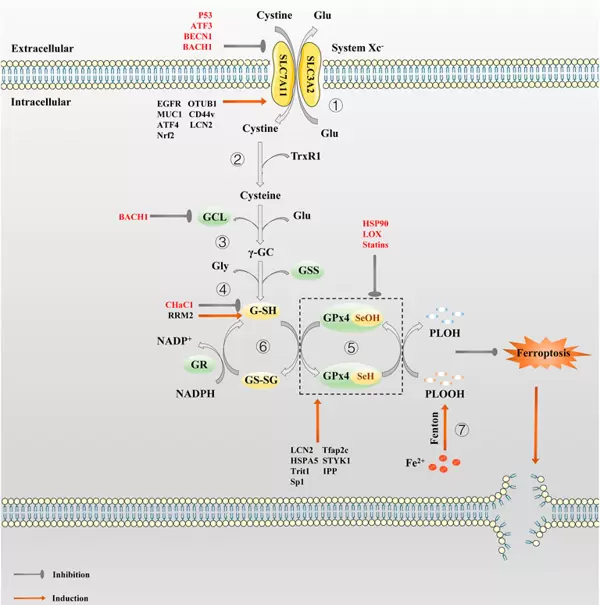
其关键机制之一在于对System Xc?的抑制。System Xc?是由SLC7A11(轻链亚基)与SLC3A2(重链亚基)共同构成的膜转运蛋白复合体,负责将胞外胱氨酸摄入细胞,同时释放胞内谷氨酸。进入细胞的胱氨酸经谷胱甘肽还原酶(GR)作用转化为半胱氨酸,后者是合成谷胱甘肽(GSH)的关键前体。GSH作为重要的抗氧化分子,在谷胱甘肽过氧化物酶4(GPX4)催化下参与清除脂质过氧化物,维持细胞氧化还原平衡[2]。
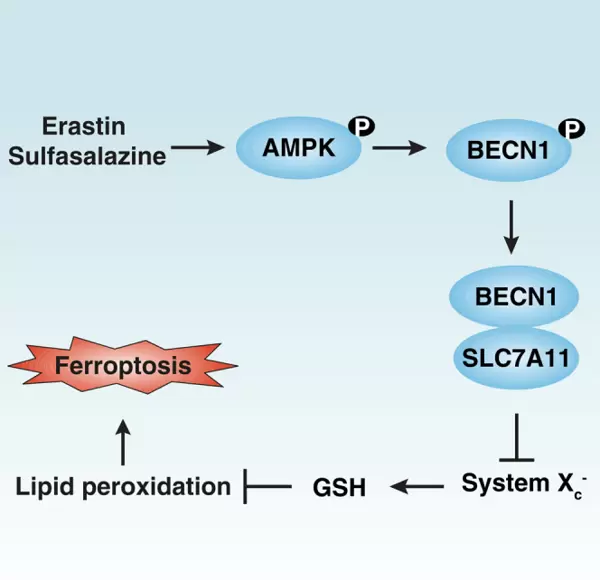
当Erastin(AbMole,M2679)存在时,可通过多种途径干扰System Xc?功能:一方面可能直接结合SLC7A11蛋白并改变其构象,阻碍胱氨酸摄取;另一方面亦有研究表明,Erastin可通过激活AMPK信号通路,促使BECN1蛋白磷酸化,进而负向调控SLC7A11的表达与活性(见图2)[3]。使用shRNA敲低BECN1可显著减轻Erastin诱导的铁死亡效应,进一步验证了该通路的重要性。
2. 对线粒体功能的调控作用
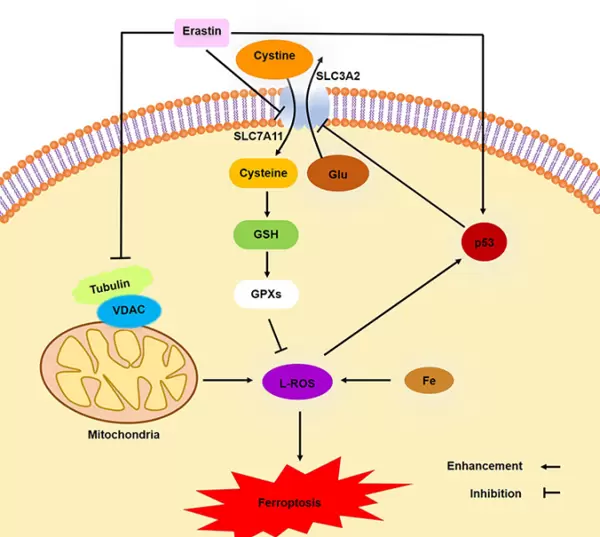
除了影响System Xc?/GSH/GPX4轴外,Erastin(AbMole,M2679)还显著干预线粒体生理功能,这也是其促发铁死亡的重要机制之一。研究显示,Erastin能够作用于电压依赖性阴离子通道VDAC2和VDAC3。在正常状态下,这些通道参与调控线粒体与胞质间的物质交换,如代谢物、离子及ATP的转运,并影响膜电位和氧化还原状态。
通常情况下,游离微管蛋白会封闭VDAC2/3通道,而Erastin可在体内外解除这种封闭效应,导致通道开放。这会引起线粒体膜电位ΔΨ升高,促进线粒体ROS生成,造成氧化应激,最终触发铁死亡过程(见图3)[4,5]。
早在2014年,AbMole提供的两款抑制剂已成功应用于动物模型实验,分别被西班牙国家心血管研究中心与美国哥伦比亚大学团队采用,并在《Nature》和《Nature Medicine》等顶级期刊发表研究成果,彰显其产品在前沿科研中的可靠性和广泛应用价值。
二、应用实例分析
1. Cell Metab. 2025 Jan 7;37(1):169-186.e9 (IF = 27.7)
该研究揭示了肠道微生物群在阿尔茨海默病(AD)发展中的关键作用。研究人员利用5xFAD转基因小鼠模型,发现梭状芽胞杆菌丰度上升及拟杆菌减少与Aβ蛋白沉积密切相关。进一步实验证明,给予卵形拟杆菌或其代谢产物溶血磷脂酰胆碱(LPC)处理后,可显著降低脑内Aβ负荷,并改善认知功能障碍。
从分子机制角度分析,LPC通过激活GPR119受体,下调ACSL4表达,从而抑制铁死亡进程,缓解AD相关病理变化。在此过程中,研究者使用AbMole提供的Erastin(AbMole,M2679)作为标准铁死亡诱导剂,处理HT22神经元细胞,以验证LPC对铁死亡的保护作用[6]。
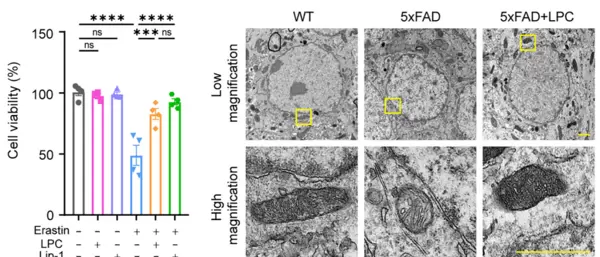
上述结果表明,Erastin不仅是一种高效的铁死亡诱导工具药,也为探索神经系统疾病中氧化损伤机制提供了重要手段。
在《Asian Journal of Pharmaceutical Sciences》2023年11月刊发表的一项研究中(IF = 10.7),科研团队深入探讨了雷公藤内酯醇(Celastrol,简称Cel)对肝细胞癌(Hepatocellular Carcinoma, HCC)的抑制作用。研究证实,Cel能够通过靶向线粒体外膜上的电压依赖性阴离子通道2(VDAC2),触发肿瘤细胞发生铁死亡(ferroptosis)与凋亡(apoptosis)双重死亡机制。
为增强Cel的靶向递送效率及其抗肿瘤活性,研究人员进一步构建了一种新型Cel脂质体递送系统(命名为AGCL)。该制剂显著提升了药物在肿瘤部位的富集能力,并强化了其治疗效果。在机制探索过程中,实验人员采用了AbMole公司提供的多种关键试剂进行对照分析,包括Erastin(AbMole,M2679)、N-乙酰半胱氨酸(NAC,AbMole,M5385)以及去铁胺(DFO,AbMole,M5558),用以验证不同细胞死亡通路的参与情况。值得注意的是,研究发现Erastin可明显增强Celastrol的细胞毒性效应,提示二者在诱导铁死亡过程中可能存在协同作用。
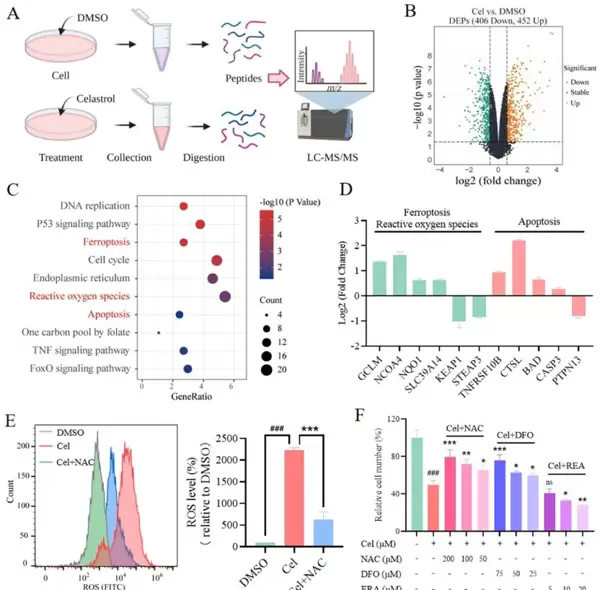
图5显示:VDAC2基因敲低会加剧Cel诱导的线粒体依赖性细胞死亡过程,进一步支持VDAC2在调控该通路中的核心地位[7]。
相关研究表明,VDAC家族蛋白在线粒体代谢与细胞死亡信号传导中扮演重要角色。此前已有文献报道RAS-RAF-MEK通路可通过电压依赖性阴离子通道引发氧化性细胞死亡 [1];而System X(c)/GSH/GPX4轴则被广泛认为是调控铁死亡的关键抗氧化体系,在耐药性实体瘤治疗中具有重要意义 [2]。此外,AMPK介导的BECN1磷酸化可通过直接抑制System X(c)活性促进铁死亡的发生 [3]。另有研究指出,Nedd4可通过泛素化修饰VDAC2/3来抑制黑色素瘤中铁死亡的启动 [4]。Erastin作为经典的铁死亡诱导剂,其在肿瘤治疗中的潜力也已被多项研究所揭示 [5]。最近的研究还发现,肠道菌群衍生的溶血磷脂酰胆碱可通过抑制铁死亡缓解阿尔茨海默病的病理进程 [6]。
本研究在此基础上进一步明确了Cel通过直接靶向VDAC2激活双重细胞死亡路径的作用机制,并为开发高效、靶向性强的肝癌治疗策略提供了理论依据和新型制剂方案[7]。
参考文献
- N. Yagoda, M. von Rechenberg, E. Zaganjor, et al., RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels, Nature 447(7146) (2007) 864-8.
- F. J. Li, H. Z. Long, Z. W. Zhou, et al., System X(c) (-)/GSH/GPX4 axis: An important antioxidant system for the ferroptosis in drug-resistant solid tumor therapy, Frontiers in pharmacology 13 (2022) 910292.
- X. Song, S. Zhu, P. Chen, et al., AMPK-Mediated BECN1 Phosphorylation Promotes Ferroptosis by Directly Blocking System X(c)(-) Activity, Current biology : CB 28(15) (2018) 2388-2399.e5.
- Yongfei Yang, Meiying Luo, Kexin Zhang, et al., Nedd4 ubiquitylates VDAC2/3 to suppress erastin-induced ferroptosis in melanoma, Nature Communications 11(1) (2020) 433.
- Y. Zhao, Y. Li, R. Zhang, et al., The Role of Erastin in Ferroptosis and Its Prospects in Cancer Therapy, OncoTargets and therapy 13 (2020) 5429-5441.
- X. Zha, X. Liu, M. Wei, et al., Microbiota-derived lysophosphatidylcholine alleviates Alzheimer's disease pathology via suppressing ferroptosis, Cell metabolism 37(1) (2025) 169-186.e9.
- P. Luo, Q. Zhang, S. Shen, et al., Mechanistic engineering of celastrol liposomes induces ferroptosis and apoptosis by directly targeting VDAC2 in hepatocellular carcinoma, Asian journal of pharmaceutical sciences 18(6) (2023) 100874.




 雷达卡
雷达卡




 京公网安备 11010802022788号
京公网安备 11010802022788号







