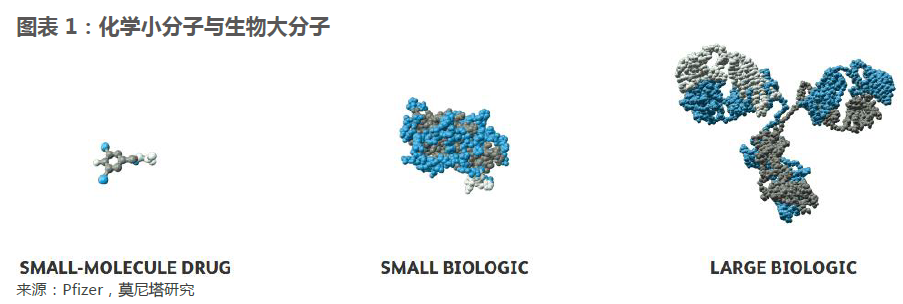
生物类似药的临床验证更加复杂。生物类似药与原研药的等效性需要更多的验证,因此其临床试验也比化学仿制药更加严格。以我国为例,我国的化学仿制药经历了野蛮生长的时期,目前正处于逐渐规范的过程中。2016年4月开始的仿制药一致性评价工作对化学仿制药的技术评价标准有了一次提升,预计未来我国的化学仿制药都将按照此次一致性评价的标准进行审批。因此我们对比一致性评价系列文件中对化学仿制药的评价标准与《生物类似药研发与评价技术指导原则》中对生物类似药的评价标准,可以发现生物类似药的评价内容更多,评价流程更复杂。
生物类似药的研发时间与费用显著高于化学仿制药,而低于创新药。因此生物类似药的研发门槛显著高于化学仿制药,生物类似药研发所需的时间与资金高于化学仿制药。一个化学仿制药的研发通常花费不会超过500万美元,以及2~4年的时间,而生物类似药则需要至少1亿美元与4~6年的时间。
原研药专利到期后,生物类似药难以快速跟进。生物类似物的研发较为困难,研发难度也比化学仿制药更高一些。比如英夫利昔单抗,商品名Remicade,其原研药的销售峰值于2016年接近70亿美元,是全球销售金额第5大的产品。该产品的欧洲专利于美国专利分别于2015年、2018年到期,巨大的市场空间自然会吸引众多仿制药公司进行研发。但是距今为止其欧洲专利到期已经过去3年,在欧洲及美国获批的类似物仅4款,与化学仿制药到期后蜂拥而至的十余家甚至而是余家接连获批的盛况截然不同。甚至部分公司在研发的过程中折戟沉沙、项目终止。
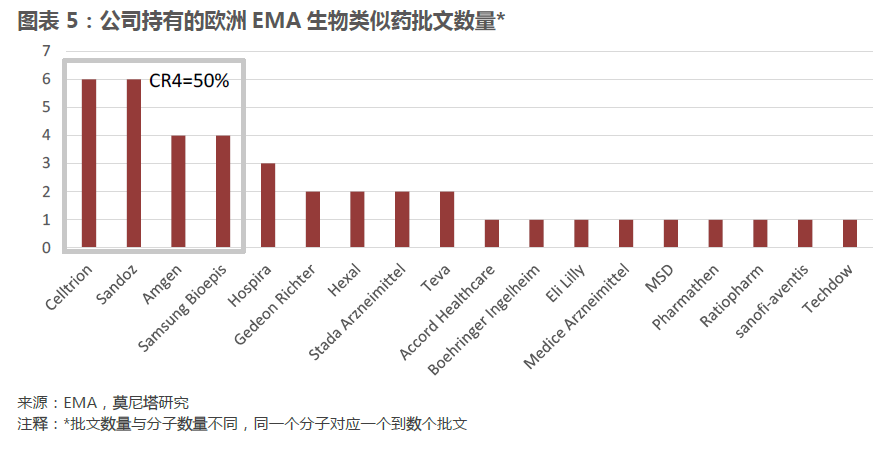
生物类似药批文数量集中于少数几家公司。欧洲EMA批准的一共40个生物类似药批文归属于18家公司,其中拥有批文最多的前四家公司覆盖了20个批文,占比50%,批文集中度较高。虽然在这18家公司中不乏Sandoz、Teva这样的传统仿制药企业,但是在领先公司中,Celltrion、Samsung Bioepis这样成立时间不久,专门进行生物类似物研发的公司的表现格外抢眼。

【免费下载】http://tinyurl.com/y8qlngzr
【备用下载】
 单抗生物医药系列报告-生物仿制药.pdf
(1.41 MB, 需要: 5 个论坛币)
单抗生物医药系列报告-生物仿制药.pdf
(1.41 MB, 需要: 5 个论坛币)




 雷达卡
雷达卡





 京公网安备 11010802022788号
京公网安备 11010802022788号







