核酸是由核苷酸单体聚合而成的生物大分子,作为生命活动中不可或缺的核心物质之一,主要分为脱氧核糖核酸(DNA)和核糖核酸(RNA)。在绝大多数生物体内,DNA 扮演着遗传信息载体的角色,是实现遗传信息传递与表达的关键。为了开展对 DNA 的深入研究,首先需要从复杂的生物样本中将其分离并纯化,去除蛋白质、多糖、脂质等干扰成分。因此,DNA 提取成为分子生物学实验中的基础步骤。目前存在多种 DNA 提取方法,以下将系统梳理常见方法的原理、操作要点及其特点。
一、DNA 提取的基本目标与主要分类
DNA 提取的根本任务是从细胞或组织等生物材料中获得纯净且结构完整的 DNA 分子,需满足两个核心要求:一是有效破坏细胞结构以释放 DNA;二是高效去除杂质,同时避免 DNA 断裂或降解。根据技术手段的不同,常规提取方法可分为三大类:物理法、化学法以及试剂盒法。
Q:DNA 提取的主要目标是什么?
A:主要目标是从生物样本中实现 DNA 的纯化与回收,既要通过裂解细胞释放 DNA,又要彻底清除蛋白质、多糖和脂类等杂质,并保持 DNA 的完整性,以满足后续如 PCR 扩增、基因测序等实验的需求。
二、基于物理作用的 DNA 提取方法
物理法依赖于机械力或能量形式(如离心、研磨、超声波、冻融)来破坏细胞壁和细胞膜,从而使细胞内的 DNA 释放到溶液体系中,该过程不涉及特异性化学反应。
1. 常见物理处理方式及适用范围
- 离心:适用于悬浮生长的细胞类型(如细菌、酵母),利用高速旋转使细胞沉淀富集,便于后续裂解操作;
- 研磨:针对植物叶片、动物肌肉等固体组织,使用匀浆器或研钵进行物理破碎,使细胞充分分散并破裂;
- 超声波处理:借助高频振动产生的剪切力破坏细胞膜,适用于细胞悬液或软组织,可快速完成裂解;
- 冻融循环:通过反复冷冻(-20℃ 或 -80℃)与室温融化,使细胞内形成冰晶膨胀,从而撑破细胞结构,适用于对化学试剂敏感或易失活的样本。
2. 物理法的优势与局限性
优点:流程简单,无需复杂试剂或昂贵设备;适用性强,尤其适合对化学环境敏感的样本;能较好保留 DNA 的天然构象。
缺点:操作过程中容易引入外源污染物,导致提取物纯度不高,常需额外纯化步骤;剧烈的机械作用可能导致 DNA 链断裂;对于富含多糖或多脂的组织(如果实、脂肪组织),裂解效率低,残留杂质较多。
Q:冻融法如何实现细胞裂解?
A:冻融法通过“冷冻—融化”循环发挥作用:冷冻阶段,细胞内部水分结冰,体积膨胀,造成细胞膜和细胞壁破裂;融化后,细胞内容物(包括 DNA)被释放至提取液中,实现裂解。
Q:为何物理法提取的 DNA 通常需要进一步纯化?
A:因为物理法仅依靠机械方式破坏细胞,无法选择性地去除蛋白质、多糖等共存物质,且在研磨等操作中可能混入外来杂质,因此所得 DNA 纯度较低,必须通过柱层析或其他纯化手段提升质量。
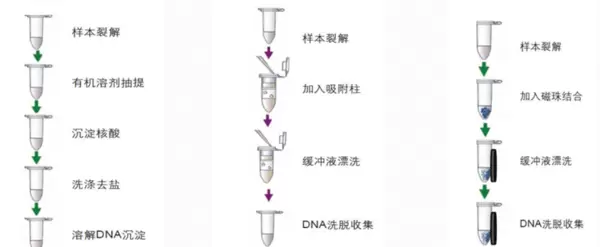
三、基于化学试剂的 DNA 分离技术
化学法利用特定化学试剂完成细胞裂解、杂质去除及 DNA 溶解/沉淀的调控,虽然操作较复杂,但能显著提高 DNA 的纯度。常用方法包括酚-氯仿抽提法、盐溶解法和异硫氰酸胍法。
1. 酚-氯仿抽提法
原理:利用酚与氯仿的有机特性实现相分离——酚能使蛋白质变性并溶入有机相,氯佧则增强去蛋白效果并清除脂类;而 DNA 保留在水相中。经离心分层后收集水相,再通过异丙醇沉淀和乙醇洗涤即可获得高纯度 DNA。
主要步骤:细胞裂解 → 加入酚-氯仿混合液 → 离心分层 → 收集上清水相 → 异丙醇沉淀 DNA → 乙醇洗涤 → 干燥后溶解。
优缺点分析:
- 优点:试剂成本低廉,均为实验室常规配备;提取的 DNA 纯度高、结构完整,适合长期保存及用于构建文库;无需专用仪器,通用性强。
- 缺点:操作流程繁琐,需多次转移液体和离心,增加交叉污染风险;酚与氯仿具有较强毒性,长期接触危害健康;耗时较长,不适合处理微量或高通量样本。
Q:为什么酚-氯仿法能够得到高纯度的 DNA?
A:关键在于其选择性分离机制:酚可使蛋白质变性进入有机相,氯仿有助于去除脂质并强化分离效果,离心后形成清晰的两相体系(有机相含杂质,水相含 DNA),通过吸取水相即可实现 DNA 的高效纯化。
2. 盐溶解法
原理:依据 DNA 在不同浓度盐溶液中的溶解度差异进行分离——在低盐条件下 DNA 易溶于水,在高盐环境中则因电荷屏蔽效应而析出沉淀。通过调节盐浓度实现 DNA 与杂质的分离。
基本流程:细胞裂解 → 添加高浓度盐溶液促使 DNA 沉淀 → 离心收集沉淀 → 洗脱去除残留杂质 → 乙醇洗涤 → 干燥后溶解。
优势与不足:
- 优点:操作简便,所需试剂少,仅需离心机等基础设备;提取速度快,约 30 分钟内可完成;成本低廉,适合小型实验室常规使用。
三、异硫氰酸胍法
原理:异硫氰酸胍具有快速变性蛋白质和破坏细胞膜的能力,同时能有效抑制核酸酶的活性,防止DNA在提取过程中被降解。随后通过沉淀与洗涤步骤实现DNA的分离与纯化。
核心流程:细胞裂解 → 加入异硫氰酸胍溶液 → 去除蛋白等杂质 → 异丙醇沉淀DNA → 乙醇洗涤 → 干燥并溶解DNA。
优势特点:
- 提取效率较高,因异硫氰酸胍可迅速释放DNA;
- DNA纯度良好,经处理后能满足多数分子生物学实验要求;
- 适用样本类型广泛,包括组织、血液及培养细胞等多种来源。
局限性:
- 试剂成本相对较高;
- 具有一定毒性,长期接触可能对操作人员健康造成影响;
- 相比盐溶解法,操作更复杂,需精确控制试剂用量与反应时间。
Q:为何异硫氰酸胍法能够防止DNA降解?
A:该方法中的异硫氰酸胍可通过破坏核酸酶的空间结构,使其失去催化活性。由于核酸酶是导致DNA降解的关键成分,其失活后即可有效保护DNA的完整性。

四、基于试剂盒的DNA提取:标准化与高效纯化的代表
试剂盒法利用预装试剂与特异性吸附材料(如磁珠或硅胶膜),显著简化了DNA提取过程,具备高重复性与高效率,已成为现代实验室主流技术之一。主要分为磁珠法和硅胶柱法两类。
1. 磁珠法
作用机制:磁珠表面修饰有特定官能团(如羧基或羟基),在设定的pH值与盐浓度条件下,可选择性结合DNA形成“DNA-磁珠复合物”。在外加磁场作用下,复合物得以快速分离,杂质保留在溶液中,最终通过洗脱液将DNA释放出来。
基本步骤:细胞裂解 → 添加磁珠悬液 → DNA与磁珠结合 → 磁场分离 → 多次洗涤去除污染物 → 洗脱获得纯净DNA。
优点:
- 提取速度快,通常30–60分钟内完成;
- DNA纯度高,能有效清除非目标物质;
- 兼容多种样本类型,如细胞、组织、全血等。
缺点:
- 整体成本偏高,依赖商业化试剂盒;
- 对样本特性敏感,不同类型样本需匹配专用磁珠以保障效率;
- 需要配套设备(如磁力架),且操作熟练度会影响结果稳定性。
2. 硅胶柱法
工作原理:硅胶膜置于离心柱内,在高盐、低pH环境下可特异性吸附DNA;而在低盐、高pH条件下则释放DNA。借助离心力驱动液体流过膜材,实现DNA的选择性捕获、清洗与回收。
主要流程:细胞裂解 → 将裂解液上样至硅胶柱 → 离心使DNA吸附于膜上 → 使用洗涤液去除非特异性杂质 → 加入洗脱缓冲液获取DNA。
优势:
- 操作简便,仅需常规离心机即可完成;
- DNA纯度高,可有效去除蛋白质、多糖及盐类残留;
- 回收率稳定,得益于硅胶膜较强的结合能力且不易堵塞。
不足之处:
- 单次使用耗材成本较高,需购买专用离心柱;
- 不适合大批量样本处理——大量样本需多个柱子,增加时间和经济成本;
- 若未及时更换离心管,存在交叉污染风险。
Q:磁珠法与硅胶柱法在DNA吸附机制上有何不同?
A:磁珠法依靠磁性颗粒表面的功能基团与DNA发生特异性结合,并通过外加磁场实现固液分离;而硅胶柱法则依赖硅胶膜在特定盐浓度和pH条件下的吸附特性,利用离心力让杂质随流动相排出,DNA则滞留于膜上,后续再行洗脱。
Q:相比传统物理或化学方法,试剂盒法的核心优势是什么?
A:其核心优势在于“标准化”与“高效性”——所有试剂预先配制,无需自行调配;操作流程固定,减少人为误差;专用载体可实现DNA的高度特异性富集,显著降低杂质残留;整个过程可在30–60分钟内完成,远快于酚-氯仿法等传统手段(后者常需数小时),且无需额外纯化步骤。
五、DNA提取方法的选择与技术演进
1. 方法选择的关键考量因素
实际应用中应根据以下维度综合评估最优方案:
- 实验目的:对于高灵敏度检测(如基因测序、SNP分析),推荐采用高纯度方法(如酚-氯仿法或试剂盒法);若仅为常规PCR筛查,则可选用盐溶解法或物理破碎法以节省时间与成本。
- 样本性质:悬浮细胞适合采用离心裂解方式;固体组织宜用研磨辅助裂解;富含糖类或脂质的样本(如植物组织)建议使用化学法或专用试剂盒,以提高提取效率。
- 成本与设备条件:小型或预算有限的实验室可优先考虑盐溶解法或机械破碎法;具备条件者则推荐使用试剂盒法以提升一致性与产出质量。
- 时间要求:紧急项目宜选快速方法(如试剂盒法或盐溶解法);若无紧迫时限,可采用耗时较长但纯度更高的经典方法(如酚-氯仿抽提)。
2. 技术发展趋势
随着生物技术进步,DNA提取正朝着更高效率、更小体积与更高通量方向发展:
- 纳米材料的应用:如功能化纳米颗粒可增强DNA吸附能力,提升提取得率与速度;
- 微流控与芯片技术:实现微量样本的精准提取,适用于珍贵或稀有样本;
- 自动化平台集成:自动核酸提取仪可减少人工干预,降低污染概率,同时大幅提升处理通量,适用于大规模筛查场景。
Q:若需从含较多糖类和纤维素的植物叶片中提取DNA,应优先选择哪种方法?
A:建议优先选用试剂盒法(特别是针对植物组织优化的硅胶柱或磁珠试剂盒),因其能有效去除多糖、多酚等干扰物质,确保DNA纯度满足下游实验需求。若条件受限,也可尝试改良的CTAB法结合酚-氯仿抽提,但需增加纯化步骤以提升质量。
对于植物叶片的处理,推荐优先采用试剂盒法(如磁珠法或硅胶柱法)或酚-氯仿法进行提取。这两种方法在实际应用中均表现出较高的核酸提取效率和纯度。
其中,试剂盒法操作简便、快速,适合高通量样本处理,能够有效减少有机溶剂的使用,降低对人体的危害。
而酚-氯仿法则基于传统的有机溶剂抽提原理,适用于某些难以裂解或多糖多酚含量较高的植物材料,在保证提取质量方面具有一定的优势。
根据实验条件和样本特性选择合适的方法,有助于提升后续分子生物学实验的稳定性和可靠性。




 雷达卡
雷达卡




 京公网安备 11010802022788号
京公网安备 11010802022788号







